研究紹介
研究概要
私たちの教室では歴史的に化学発癌を中心としたがん研究を行っており、実験動物発がんモデルを樹立し、それらを用いて、多段階発がんメカニズムおよびそれらに対する発がん修飾因子の検討をしています。今までに全身諸臓器における発がん研究を行ってきましたが、現在では、前立腺癌、肝癌、膀胱癌、消化器癌を中心に研究を進めています。発がん修飾因子を検討することでがんの進展要因を見出し、ヒトにおけるがんの予防・治療に有用な情報を得る事を目的としています。また、ヒトの臨床検体を用いた臨床病理学的研究も同時に進めており、婦人科腫瘍、前立腺癌、乳癌、消化器癌など中心に臨床科と連携しながら進めています。
主な研究テーマ
- テーマ一覧メニュー
前立腺癌に対するがん予防物質の探求
前立腺癌は年齢が進むにつれて発症率が増加する悪性腫瘍で、50歳以下では前立腺癌の発症は稀で、70歳代、80歳代と急速に増加しています。高齢化社会を迎え、さらに食事の欧米化に伴って急増しており、2020年には肺癌についで2番目の罹患率になると予測されている増加率一番の癌であります。日本においては前立腺癌の発症率、死亡率は欧米諸国に比較して10分の1ほどでありましたが、最近では3倍ほどの差に縮まっています。しかし病理解剖で発見される前立腺潜在癌の発症率は欧米諸国に比較しても大差はなく、日本人においても前立腺癌(臨床癌)の発症する基盤が十二分にあることが予測されていました。すなわち何らかの前立腺癌の発育促進因子が働けば、臨床的に診断しうる癌に容易に進展すると考えられ、事実最近の前立腺癌の急増はその予測を裏付けた結果とも言えます。これらのことから、長い潜伏期間を経て臨床癌へ進展する間にしかるべき対応をすることによって前立腺癌の発症を予防することができると考えられ、化学予防は前立腺癌の重要課題の一つであります。我々の教室では、多数のラット前立腺癌モデルを樹立し(DMABモデル:Cancer Res, 46:6423-6426, 1986; DMAB+TPモデル:Cancer Res, 51:1264-1269, 1991; TRAPモデル:Cancer Res, 61:4693-4700, 2001)、これらのモデルを用いて前立腺癌化学予防の候補物質を長年にわたってスクリーニングしてきました(表参照)。その中で、横浜市立大学泌尿器科との共同研究で行ったアンギオテンシン受容体阻害剤を用いた研究では、プロテアソーム経路を活性化する事によりアンドロゲン受容体(AR)発現を低下させ、前立腺癌の進展を効果することを明らかにしてきました。前立腺癌摘出患者を対象にした臨床介入試験においても、術後のPSA再発を抑制する事を見出しており、アンギオテンシン受容体阻害剤はヒト前立腺癌化学予防物質として有望であることが明らかとなりました。現在も前立腺癌予防物質のさらなるスクリーニングを行っているところです。
| 動物モデル | 被検物質 | 効果 | 作用機序 | 文献 |
|---|---|---|---|---|
| DMAB | セレニウム α-トコフェロール γ-オリザノール |
― ― ― |
Cancer Lett, 58:241-246, 1991. | |
| DMAB | コレステロール サポニン クロフィブレート |
― ― ― |
Prostate, 20:179-185, 1992. | |
| DMAB DMAB + TP |
インドメタシン | ― | Jpn J Cancer Res, 88:350-355, 1997. | |
| DMAB DMAB + TP |
タモキシフェン | ― | Prostate, 31:9-13, 1997. | |
| DMAB DMAB + TP |
ゲニスチン ダイジン |
抑制 抑制 |
Jpn J Cancer Res, 91:786-791, 2000. | |
| DMAB PhIP |
リコぺン クルクミン |
― ― |
Carcinogenesis, 22:467-472, 2001. | |
| DMAB + TP | 牛脂 ペリラ油 コーン油 |
促進 ― ― |
Jpn J Cancer Res, 92:1026-1033, 2001. | |
| PhIP | フジフラボンP40 | 抑制 | Prothymosin-α発現抑制 | Carcinogenesis, 25:381-387, 2004. |
| TRAP | リュープロレリン | 抑制 | 血中テストステロン低下 | Cancer Sci, 97:459-467, 2006. |
| TRAP | フィナステリド フルタミド |
抑制 抑制 |
5α-リダクターゼ阻害 | Prostate Cancer Prostatic Dis, 10:378-383, 2007. |
| TRAP | ノビレチン オーラプテン |
抑制 抑制 |
細胞周期停止に伴うアポトーシス亢進 | Cancer Sci, 98:471-477, 2007. |
| TRAP | レスベラトロール | 抑制 | AR発現抑制 | Asian Pac J Cancer Prev, 9:7-14, 2008. |
| TRAP | γ-トコフェロール | 抑制 | Caspase活性亢進 | Prostate, 69:644-651, 2009. |
| TRAP | 大豆由来Bowman-Birk プロテアーゼ阻害剤 |
抑制 | Connexin43発現上昇に伴うアポトーシス亢進 | Pathol Int, 59:790-796, 2009. |
| TRAP | アンギオテンシンⅡ 受容体(AT1)阻害剤 |
抑制 | AR発現抑制、ER-beta発現上昇、MAPK不活化 | Prostate, 72:1559-1572, 2012. |
| TRAP | 紫トウモロコシ色素 | 抑制 | Cyclin D1発現抑制 | Cancer Sci, 104:298-303, 2013. |
| TRAP | アポシニン | 抑制 | Cyclin D1, clusterin発現抑制 | Cancer Sci, 104:1711-1717, 2013. |
| TRAP | エラグ酸 | 抑制 | Caspase活性化を介したアポトーシス誘導 | Prostate, 75:151-160, 2015. |
| TRAP | 発酵玄米 (FBRA) | 抑制 | AMPK活性化 | Nutrients, 8:421, 2016. |
| TRAP | HDAC阻害剤(OBP801) | 抑制 | miR-302を介したAR発現抑制 | Cancer Res, 76:4192-4204, 2016. |
| TRAP | ピオグリタゾン | 抑制 | NF-kBシグナル経路抑制 | Int J Mol Sci, 17:2071, 2016. |
| TRAP | アンギオテンシンⅡ 受容体(AT2)作動剤 |
抑制 | AR発現抑制、Caspase活性亢進 | Oncotarget, 9:13859-13869, 2018. |
| TRAP | 紫米色素 | 抑制 | AR, Nkx3.1発現抑制 | Nutrients, 12:558, 2020. |
| TRAP | ルテオリン | 抑制 | 酸化ストレス関連遺伝子発現抑制、Caspase活性亢進 | Carcinogenesis, 41:1145-1157, 2020 |
TP, プロピオン酸テストステロン; −, 効果なし
Connexin遺伝子による肝細胞死および発がん制御機構の解析
Connexin (Cx)は細胞間結合装置の一つであるギャップ結合を構成するタンパクです。ギャップ結合は、隣接細胞間で小分子交換を行うという、他の細胞間結合装置にはない機能を持っています。私たちの研究室では、独自に作製したCx遺伝子改変ラットモデルやCx遺伝子導入癌細胞を用いた研究を進めており、これまでに細胞間コミュニケーション機能の異常が、肝におけるアポトーシス誘導障害や発がん促進に関わることを明らかにしてきました (Toxicol Pathol, 38:80-286, 2010; Cancer Sci, 103:860-867, 2012)。加齢に伴い肝細胞のCxタンパク発現や細胞間コミュニケーション機能が低下し、肝発がん性感受性を亢進させることもわかってきました (Toxicol Pathol, 40:715-721, 2012)。また、Cx遺伝子改変ラットを用いた非アルコール性脂肪肝炎(NASH)モデルを作成し、エゴマの種子に多く含まれるフラボノイド、ルテオリンがNASHの発症を抑制することを見出しました(Carcinogenesis, 36:1539-1549, 2015)。これらの基礎的研究を蓄積し、最終的にはヒトのがん予防や治療法の開発に役立つようアプローチしたいと思っています。
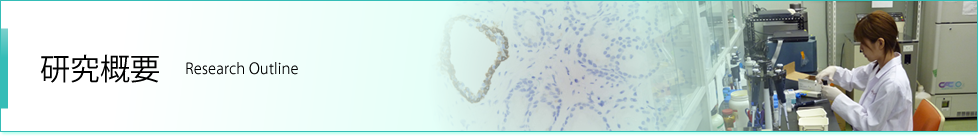
ラット正常肝におけるCxタンパクの局在. 赤:Cx32, 緑:Cx26.
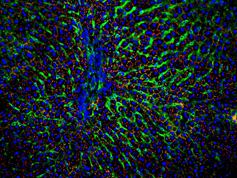
高用量アセトアミノフェンによるラット肝障害.
障害肝細胞ではCx43タンパク発現が誘導される.
赤:Cx43, 緑:Cx32.
酸化ストレス応答遺伝子による前立腺癌、肝癌増殖機構の解明
生体における酸化ストレスの蓄積は、ゲノム変異やエピジェネティック変化を介し、細胞増殖や細胞死制御に影響を及ぼし、細胞のがん化過程に深く関与していることがわかっています。私たちは、網羅的遺伝子解析を行い、酸化ストレス制御因子であるGlutathione peroxidase 2 (GPX2)やGlutathione S-transferase placental form (GST-P)が、肝癌、前立腺癌、膀胱癌、乳癌など、複数の癌腫において発現亢進していることを見出しました(Cancer Res, 67:11353-11358, 2007; Carcinogenesis, 29:1134-1138, 2009; Prostate, 72:533-541, 2012; Toxicology, 311:115-123, 2013; Oncotarget, 9:15847-15859, 2018)。これらの遺伝子は、ラット発がんモデルおよびヒト癌細胞を用いた研究から、酸化ストレスの制御を介して癌細胞の増殖や細胞死を調節していることがわかってきました。さらにGPX2に関しては、発がんに対して担う役割や過程が、臓器により多様であることが明らかになりつつあります。今後は、GPX2やGST-Pを診断マーカーあるいは治療標的など、各々の癌に対して最適な手段として活用できるよう研究を進めていきたいと考えています。
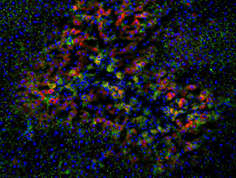
内分泌療法未治療前立腺癌におけるGpx2発現
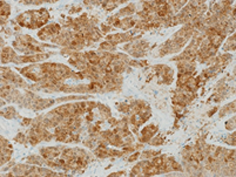
去勢抵抗性前立腺癌におけるGpx2発現
ラット肝発癌における各病変と、発癌進展機序の研究
ラットにおける発癌機序を検討するために、ラット肝組織の前癌病変であるGST-P(Glutathione S-Transferase)陽性細胞巣に特異的な遺伝子発現をマイクロアレイ解析により検討し、グルタチオン関連酵素発現上昇などを確認しました(Carcinogenesis, 25:439-443, 2004)。また、ラット肝発癌課程において良性腫瘍から悪性化する際に重要な遺伝子をマイクロアレイで検討し、high mobility group box (HMGB) 2やRat Hepatocyte Malignant Transforming Factor (HMTF)が腫瘍進展に関与することを見いだしました(Toxicol, 255:160-170, 2009; Toxicol Pathol, 39:1084-1090, 2011)。転移や浸潤能の異なるラット肝癌細胞株における遺伝子発現差をマイクロアレイで検討し、connexin 43やGlutathione peroxidase 2 (GPX2)が転移や進展に関わることを証明しました(Cancer Sci, 103:860-867, 2012; Toxicology, 311:115-123, 2013)。今後もより早期に起こる発癌メカニズムの解明や、ラット肝発癌モデルを介してヒトでの発癌機序解明を進めていきたいと考えています。
膵発癌進展に対する予防・治療法確立を目指した実験的、臨床病理学的研究
膵癌は治療抵抗性で極めて予後不良であり、その予防法の確立は重要な課題であります。現在、種々の動物モデルを用いて膵発癌進展を抑制する因子、治療法確立を目指した研究を行っています。近年の疫学的調査から血中アディポネクチン濃度が低い症例では膵発癌リスクが高い事が示されています。そこで私たちはこの研究データを検証するために内因性アディポネクチン誘導物質として報告されているポリフェノールのレスベラトロール、NADPHオキシダーゼ阻害薬であるアポシニンに着目して動物モデルを用いた研究を進めました。その結果、両者とも血中アディポネクチンを上昇させることはできせませんでしたが、膵発癌を有意に抑制する事が明らかとなりました。膵癌細胞株を用いた解析により、この抑制メカニズムはAKT-GSK3βおよびERK1/2シグナル経路を介したものである事を見出しました(Oncotarget, 6:42963-42975, 2015)。また、胆・膵内科との共同研究により、腹膜播種を来した膵癌に対する光線力学療法、Class III β-tubulin発現が消失している切除不能膵癌ではタキサン系薬剤に対する感受性が高いことを明らかにしています(Mol Cancer Ther, 16:1124-1132, 2017; Human Pathol, 74:92-98, 2018)。今後も動物モデルを用いた膵癌研究を行い、それらのデータをヒトに還元することで膵癌の予防、新たな治療法確立に貢献したいと考えています。
免疫逃避による腫瘍増殖・進展メカニズムの解析
大腸癌、悪性胸膜中皮腫をはじめとする腫瘍組織アレイを用いて、PD-L1(CD274)やCD70など、免疫制御関連分子の網羅的発現解析を行い、各分子を発現する腫瘍の病理学的特徴や分子標的治療の候補疾患・患者の同定を試みています(Am J Surg Pathol, 40:1133-42, 2016; Mod Pathol, 30:278-285, 2017; Hum Pathol, 71:1-7, 2018)。また、培養細胞、動物モデルを用いた分子生物学的解析から、腫瘍細胞が制御性T細胞(Treg細胞)の誘導や、エフェクターT 細胞(effecter T細胞)の疲弊などを介して、宿主の免疫機構から逃避し、増殖・進展していくメカニズムの解析も行っています(J Pathol Clin Res, 3:268-278, 2017; J Pathol, 250:205-216, 2020)。
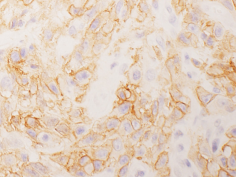
悪性胸膜中皮腫におけるPD-L1(CD274)発現
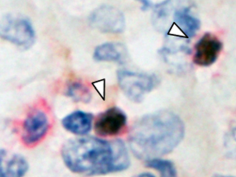
悪性胸膜中皮腫微小環境における制御性T細胞(矢頭; 赤, CD4; 茶, FoxP3)