1)危険因子APOE4の発症機構における役割の解明とそれに介入する予防・治療法開発に関する研究
2)アルツハイマー病発症機構における危険因子である糖尿病病態の役割の解明と予防治療標的の解明に関する研究
3)新規血液診断マーカーの発見とそれを基盤にした診断法開発研究
4)アミロイド蓄積およびAβ代謝(産生、分解)制御メカニズムに関する研究
5)食品成分、腸内細菌がアルツハイマー病病態に及ぼす影響に関する研究
6)口腔疾患とアルツハイマー病分子病態に関する研究
危険因子APOE4の発症機構における役割の解明とそれに介入する予防・治療法開発に関する研究
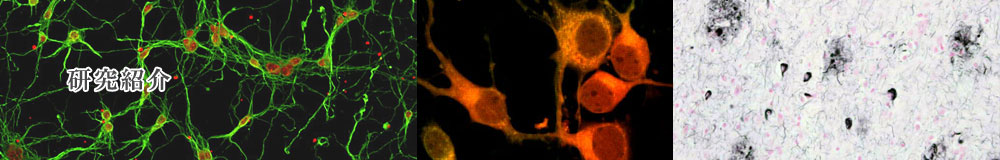
最も強力な危険因子は、脳内脂質代謝に重要な役割を担っているapolipoprotein E (ApoE)の対立遺伝子ε4であることが分かっています。 ApoEは脳内脂質代謝にHDL産生とその供給を通して重要な役割を果たしていると考えられていましたが、我々はHDL作用作用がapoE3, apoE4で異なることなどApoEならびにapoEが輸送する脂質代謝変動とアルツハイマー病分子病態に関する多くの発見を報告してきました。 脳内の脂質輸送を司るApoE-HDLはAβと結合することが知られ、ApoE-HDLと結合したAβは、ApoE受容体を介して細胞に取り込まれ、あるいは細胞外分解酵素により分解・除去さえると考えられています。したがって、ApoE-HDL産生制御は、Aβ分解除去を左右すると考えられており、ApoE作用の増強(分泌量の増加)が予防・治療の標的と考えています。
脳内の脂質代謝、特に細胞膜構成脂質代謝の変化(コレステロール、リン脂質、スフィンゴ脂質などの代謝変動)が、 Aβの産生に影響すると考えられています。その主な理由は、 Aβの基質であるAPP、APPを2カ所で切断してAβを産生するβ-secretase, γ-secretaseとも膜タンパク質であるためです。また、細胞膜脂質の構成変動は、 Aβ毒性発揮の本態と考えられるAβ重合体形成の場として重要であること、またアルツハイマー病のもう一つの本質的病態であるタウオパチー (神経変性)も脂質代謝に関連するシグナル系との関係と関連することを報告してきました。
現在、脳内ApoEの産生促進、あるいは分解抑制作用のある化合物の同定、食品成分などの同定とその応用による予防法の開発について研究を行っています。
アルツハイマー病発症機構における危険因子である糖尿病病態の役割の解明と予防治療標的の解明に関する研究
糖尿病はアルツハイマー病(AD)の危険因子であり、AD発症リスクを約2倍に増加させることが明らかとなっています。AD脳ではインスリンやインスリン受容体の量が低下し、脳内インスリンシグナルの障害は新たなAD病態の一つとして注目されています。AD脳の病理学的特徴の一つとして過剰なタウタンパク質のリン酸化によって生じる神経原線維変化が知られています。特に脳内のインスリン欠乏によるリン酸化タウタンパク質の亢進などが報告されていますが、そのメカニズムは未だに不明なことが多いです。私たちは、インスリン欠乏によるタウタンパク質のリン酸化亢進メカニズムを明らかにするためADモデルマウスにストレプトゾトシンを投与し、1型糖尿病を誘発させ、脳内で変動する分子を2次元電気泳動-質量分析法で網羅的に解析し、インスリン欠乏によって変動する分子の探索を行いました。現在、変動したいくつかの新規分子を用いてタウタンパク質のリン酸化における機能解析を行っています。この新規分子によるタウタンパク質のリン酸化亢進メカニズムが明らかになれば、新規分子をターゲットとしたADの新たな治療・予防法などの開発に繋がることを期待しています。
新規血液診断マーカーの発見とそれを基盤にした診断法開発研究
現在までのアルツハイマー病(AD)研究により、発症後よりもアミロイド病理形成のなるべく早期の段階あるいは軽度認知障害(MCI)段階で治療すべきであると考えられるようになった。2019年末に米国FDAに認可申請されたアミロイドを標的にした疾患修飾薬アディカヌマブ(抗体療法)の治験において、早期AD、MCIに対する効果が明らかとなり、2021年6月にFDAで治療薬として認可された。わが国においても近いうちに治療開始が予想されることから、簡便な診断マーカーの重要性は著しく高まっている。しかしながら、現状におけるADの診断法は、髄液検査やPET検査(脳内Aβ沈着検出)が用いられるが、髄液検査は侵襲を伴い、PET検査は高価で実施可能な施設も限られるため、一般病院での検査は困難である。
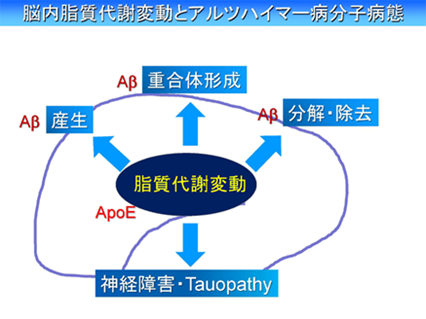
我々は、血中のフロチリンタンパク質が、PET検査で診断したAD、PET陽性のMCIならびに剖検で確定診断がついたADの血清のフロチリンレベルが、健常者、PET陰性MCI、血管性認知症患者血清におけるフロチリンレベルに比し、それぞれ有意に低下することを発見し、診断マーカーとしての可能性を見出した(abdullah et al, J Alzheimers Dis, 72: 1165-1176, 2019)(外国出願:PCT/JP2018/018849)。 現在、ELISAによる血液診断法の確立に向けた開発研究を行っている。
また、なぜ脳内事象であるアルツハイマー病分子病態を血液中のマーカーの変化として捉えることができるか、その分子メカニズムが不明であることから、現在分子メカニズム解明のための基礎研究を行ってる。
Abdullah et al. J.Alzheimers Dis 2019
アミロイド蓄積およびAβ代謝(産生、分解)制御メカニズムに関する研究
アルツハイマー病の発症には、アミロイドβ蛋白(Aβ)の脳内蓄積が深くかかわっていると考えられている。我々は、世界に先駆けてAβ42は強い毒性を発揮するが、Aβ40は神経保護作用を持つことを見出した。すなわち、(i) Aβ42は強い凝集性を持つため神経毒性を発揮するが、単体で存在しうるAβ40は遷移金属をキレートして活性酸素の発生を抑制し、活性酸素による神経細胞死を抑制する。(ii) 単体Aβ40はAβ42と結合することにより、Aβ42のβ-sheet形成を阻害し、Aβ42の重合体形成・線維化を抑制する。その結果、単体Aβ40には、Aβ42のもつ神経毒性を抑制する作用があることを明らかにした。これらの発見は、家族アルツハイマー病患者の血清や脳脊髄液で発見されているAβ42/Aβ40比の上昇現象に理論的根拠を提供することになった。さらに、我々は、毒性の強いAβ42からアミノ酸2つ切り出して神経保護作用を持つAβ40に変換する(Aβ変換)酵素をアンギオテンシン変換酵素(ACE)であることを特定した。興味深いことに、我々は、Aβ変換活性とangiotensin変換活性がACEの異なるドメインにそれぞれ存在することも発見した(図)。
最近、我々は、Aβ産生に関わるγセクレターゼの中心分子であるプレセニリンが孤発性アルツハイマー病の発症機構(Aβ分解)にも関与する分子メカニズムを見出し、家族性と孤発性アルツハイマー病の共通発症機序の解明に向けて研究を行っている。
食品成分、腸内細菌がアルツハイマー病病態に及ぼす影響に関する研究
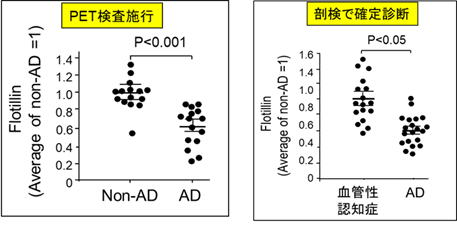
アルツハイマー病の記憶障害と病態に対するラクトフェリンの効果: 脳内Aβを減少させることが、アルツハイマー病(AD)治療の基本戦略として、Aβの産生抑制あるいは産生調節薬開発、分解促進薬開発などのアプローチがとられてきました。しかし、これまでにAD発症後からの治療介入では根本的な治療効果は認められていません。発症時期にはすでに脳内病態が進行し、Aβを除去あるいは低減させても効果が見られないと考えられています。以上から、ADの発症前からの予防は、発症後の治療が困難である現状を踏まえると重要な戦略であると考えます。乳由来の成分であるラクトフェリンは、活性酸素形成の阻害や酸化ストレスなどから神経細胞を保護する作用を持つことが報告されています。また,AD脳の老人斑やADモデルマウス脳にラクトフェリンが多く存在していることが報告されています。しかし、AD脳の病態におけるラクトフェリンの役割やその意義はわかっていません。私たちは、ラクトフェリンおよびラクトフェリンのペプシン分解産物をADモデルマウスに摂取させると、認知機能軽減やAβ産生酵素であるBACE1レベルを減少によるAβ産生抑制、アポリポタンパク質E(ApoE)分泌の促進、ABCトランスポーターA1発現を増加させることによってApoE-HDLレベルを増加させ, Aβ分解を促進し、脳内のAβ沈着が抑制されることを見出しました(図)。これらの結果より,ラクトフェリンおよびラクトフェリンのペプシン分解産物はADの予防物質として働く可能性があると考えています。現在、クトフェリンやその分解産物(4種類)を用いてAβ分解・除去における機能解析を行っています。
アルツハイマー病の記憶障害と病態に対するプロバイオティクスの効果 近年、腸内細菌・プロバイオティクスとADが密接に関連していることが報告されています(図)。プロバイオティクスサプリメントは、マイクロバイオームの多様性を再確立し、記憶や学習能力などの脳機能を改善しますが、それらの分子メカニズムはまだ完全には解明されていません。私たちは、ADマウスモデルを用いて、ADの記憶障害と病態に対するビフィズス菌breve MCC1274の影響を検討しています。また、RNA-sequence手法を用いてビフィズス菌breve MCC1274投与による変動する遺伝子の探索を行っています。ADの認知機能軽減やAD病態改善におけるビフィズス菌breve MCC1274の効果が確認できたら、AD進行の潜在的な予防療法として使用できることを期待しています。
口腔疾患とアルツハイマー病分子病態に関する研究
咀嚼機能低下・歯の欠損とアルツハイマー病との関連が、 複数の疫学研究によって指摘されておりますが、両者を結ぶ因果関係の分子基盤は不明です。当研究室では、 咀嚼機能低下を引き起こす2つの病態・原因として、歯の欠損ならびに液状食(キッドダイエット)を取り上げ、 これらがアルツハイマー病分子病態および記憶・学習機能へ及ぼす影響を動物モデルを用いて明らかにする研究を進めています。
すでに「流動食(soft diet)によって誘導される認知機能低下」に関しては、細胞内シグナル伝達系の変動・海馬神経脱落を来して認知機能障害を誘導することを明らかにしました。しかし、口腔と脳は近距離にあるにもかかわらず、両者をつなぐ病態メカニズムの詳細は不明であり、現在その解明のための研究を行っています。離乳時あるいは老年期において、歯牙欠損やsoft-dietによる咀嚼の低下が誘因となる認知機能障害は、それぞれ脳の発達(小児期)とアルツハイマー病発症(老年期)の予防につながる研究として意義があると考えられます。アルツハイマー病の発症予防や症状緩和に、歯科治療や食生活の改善(咀嚼すること)、咀嚼リハビリテーション等で貢献できる可能性を示せると考えています。
口腔疾患のもう1つの代表的なものに、歯周病があります。私たちは、アルツハイマー病モデルマウスに歯周病を惹起させると、 脳内のAβ沈着が増加し、認知機能障害が増悪することを確認し、それが炎症の脳内への波及によるものであることを見出しました。
こうした口腔疾患と認知症との関連が明らかになれば、比較的簡便で安価な方法により認知症予防が可能になる可能性がでてくるまた、 重要な研究ではないかと考えています。歯学部からの大学院生の参加も期待しています。
